男性不妊と生殖補助医療
男性不妊症を専門に扱う、泌尿器科の生殖医療専門医は全国で58名しかおりません(2018年12月1日現在)。
生殖医療専門医は全国で725名いますが、そのほとんどが産婦人科医であり、男性不妊症を専門に扱う泌尿器科の生殖医療専門医は全国で58名しかおりません(2018年12月1日現在)。詳しくはこちら
当院では日本生殖医学会認定の生殖医療専門医の立場から、適切なアドバイスをし、安心で安全な治療やアドバイスをご提供、ご提案します。
少子高齢化社会を迎え、不妊症治療の必要性がこれまで以上に高まっている中、近年の補助生殖技術(assisted reproductive technology ; ART)の飛躍的な進歩が男性不妊症の治療に大きな変革をもたらしています。例えば、特発性精子形成障害症例においても精巣内精子採取術(testicular sperm extraction ; TESE)により精子を少数でも採取できれば、卵細胞質内精子注入法(intracytoplasmic sperm injection ; ICSI)を用いることで受精、ひいては挙児が可能となりました。
男性不妊症の病因、病態と治療法、ARTの適応およびその問題点について概説します。
男性不妊症の診断
診断は問診から始まり身体所見(精巣容積測定など)、ホルモン検査、陰嚢超音波検査、染色体検査と順を追って進められますが、その中心となるのは精液検査です。精液中に精子を認めない無精子症、精子濃度が15×106/ml未満の乏精子症、精子運動率が40%未満の無力精子症、精液量が1.5ml未満の乏精液症などが診断されます。精巣生検は病理組織学的に造精機能を評価する必要性があると考えられる症例が適応となりますが、生検でSertoli cell only症候群やmaturation arrestと診断されるような症例でも、顕微鏡を用いて精巣内の広範囲を比較観察し、精細管の構造の違いを識別して採取部位を決めるmicrodissection TESE ( MD-TESE )にて精子回収が可能であることが少なくありません。精巣生検の所見は精巣容積や血中卵胞刺激ホルモン(FSH)値と同様に精子回収の予測因子とはならず1) 、精巣への侵襲も考慮しTESEと同時に施行されることが多いです。
男性不妊症の各病態、治療法とARTの適応
- 精巣での造精機能障害
1. 染色体異常
高度乏精子症、非閉塞性無精子症例では染色体異常のリスクは健常男性と比べ20倍高いです。ART特にICSIを施行する場合はその前に染色体異常の有無を検査することが望ましいです。染色体異常は無精子症例の15.2%で認められ、うち91.3%は性染色体異常(82.5%が47,XXY ; クラインフェルター症候群)です。乏精子症では3.6%で認められ、うち78.9%は常染色体異常(多くは構造異常)であり、ロバートソン転座がその約半数にみられます。t(13q;14q)の精子の染色体検査では、80-90%が交叉分離に伴い正常あるいは均衡型を呈すると報告されています(表1)。
クラインフェルター症候群の69.3%は射精可で、うち8.4%で射出精子を認めるとされ、例外として自然妊娠例も報告されています。本症に対するTESE成功例は1996年に最初に報告され、現在では純系の5割近くがmicro TESEにて精子回収可能であり、非閉塞性無精子症例全体での回収率と同等とされています3)。精細胞の変性は幼児期に始まり、思春期以降急速に進行します。よって不妊を呈する前に診断された若年例では、精液の凍結保存が将来の妊孕性温存につながる可能性があり、適切な症例に提示されるべきです。現在では純系の5割近くがmicro TESEにて精子回収可能であり(Int J Androl 20: 69, 1997, Hum Reprod 16: 2616, 2001, Hum Reprod 14: 741, 1999)、非閉塞性無精子症例全体での回収率と同等とされます(Hum Reprod 19: 1135, 2004)。精細胞の変性は幼児期に始まり、思春期以降急速に進行します。よって不妊を呈する前に診断された若年例では、精液の凍結保存が将来の妊孕性温存につながる可能性があり、適切な症例に提示されるべきです(Fertil Steril 76: 1054, 2001, J Androl 25: 586, 2004)。74例の純系クラインフェルター症候群の無精子症に対しmicro TESEを施行した報告では、精子回収率は56.7%で年齢と逆相関(odds ratio: 0.854)しており、クラインフェルター症候群症例では早期に妊孕性を評価し、TESEを行うことが重要としています(Urology, 68: 1082, 2006)。同じく51例での TESE施行群の報告では、26例で精子を回収できましたが35歳以降で有意に回収率が低下しており、35歳以前にTESEを勧めるべきと結論付けています(Fertil Steril, 84: 1662, 2005)。
一方、46, XX maleでは性腺に精細胞は存在せず、挙児を得るには非配偶者間人工受精(AID)しか方法はありません。
また、Y染色体長腕上のAZFc(azoospermia factor c)領域にはDAZ(deleted in azoospermia)遺伝子の4つのコピーが存在し、その領域のみの欠失の場合は無精子症であってもMD-TESE により精子を採取できる可能性があります。ただしその精子も同様の欠失を有していると考えられるので、男児を得た場合には無精子症が遺伝する可能性が高いです。また乏精子症患者においてもDAZ遺伝子欠失が2~5%の頻度で検出されます。また、同じAZFc欠失でも造精機能障害の程度は異なり、自然妊娠の報告例もあります5)。これらは、AZFc以外の未知の遺伝子や環境因子が精子形成に影響する可能性を示唆していると考えられます。更にこのAZFc領域の部分的欠失が、精子形成障害の有意なリスクファクターである可能性も指摘されていますが6)、その詳細についてはいまだ不明です。
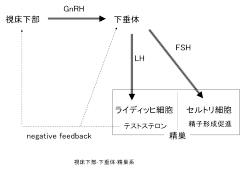
男性不妊症の中で、視床下部下垂体障害は原因に対する根本的治療法のある数少ない病態です。ゴナドトロピン放出ホルモン(GnRH)負荷試験、ヒト絨毛性ゴナドトロピン(hCG)負荷試験などにより診断します。文献的に男性不妊症における視床下部下垂体障害は健康成人男性に対して1-2%、特発性低ゴナドトロピン性性腺機能低下症に限っては1 / 10,000以下と稀です。先天性疾患(Kallmann症候群、Prader-Willi症候群、Laurence-Moon-Biedl症候群、ゴナドトロピン欠損症、黄体形成ホルモン(LH)単独欠損症)のほか、腫瘍(下垂体腺腫、頭蓋咽頭腫、星状細胞腫等)、手術、放射線治療、外傷などにより視床下部下垂体系が機能障害を起こすと、下垂体からのゴナドトロピン分泌が低下し、精巣のテストステロン分泌能、精子形成能が障害されます(図1)。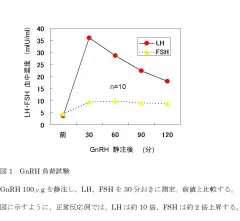
その治療目的は二次性徴の発現と造精機能の獲得であり、二次性徴を得るためには内因性にアンドロゲンを産生させるか外因性にアンドロゲンを投与します。しかし精子形成には男性ホルモン以外にFSHも必須であり、造精機能が期待できる疾患においては精巣を刺激し内因性のアンドロゲン分泌能を上昇させることから試みます。LH作用を有するhCG (human chorionic gonadotropin)とFSH作用を有するhMG (human menopausal gonadotropin)を用い、血中テストステロン値や精液所見に応じ増量します。これまでは各々閉経後女性、妊婦由来の尿から精製されたhMG 、hCG しか利用できませんでしたが、近年、より高純度で活性が特異的かつ構造や供給の安定している遺伝子組み換えヒトFSHも応用されており、従来のhMGと同等の治療効果が報告されています。hCGであるゴナトロピン(プロファシーは販売中止)Ⓡ、遺伝子組み換えヒトFSHであるゴナールエフTMは皮下注射、自己注射が可能です。LH単独欠損症ではhCG単独でも精子形成が期待されますが、hCG長期投与で抗体が産生されることもあり注意が必要です。hCG/hMG療法により血中テストステロン値が上昇せず二次性徴が発現しない場合はテストステロン補充療法の適応となります。
ゴナドトロピン補充療法の有効率は80%、精子濃度改善率は40-70%といわれます7)。下垂体腫瘍や外傷などによる後天性の低アンドロゲン症については約3ヶ月で血中テストステロン濃度は正常化し、3-6ヶ月で精子の出現をみます。先天性症例でも血中テストステロン濃度は早期に上昇しますが、1年以上後に精子の出現をみることがあり、治療効果判定には2年程度経過をみる必要があります。ホルモン補充療法とARTとの併用については、長期間のホルモン補充によりTESE-ICSIの成績が向上、もしくは自然妊娠さえも得られる可能性があり、ARTの導入は精巣の最終的な成熟が得られるまで待つべきという意見があります8)。一方で、ARTの早期導入は患者の治療コンプライアンスを上げるとの考え方もあり、個々の症例の社会的、年齢的、経済的背景に即した対応が必要と考えます。
低ゴナドトロピン性性腺機能低下症の治療
・GnRH療法:
GnRH 25ng/kg、12回/日、皮下注
・ゴナドトロピン療法:
hCG 1000~5000単位 + hMG 75~150単位、2~3回/週、筋注
hCG 1000~5000単位 + 遺伝子組み換えヒトFSH 150~300単位、
2~3回/週、皮下注(自己注射可能)
・テストステロン補充療法:
エナント酸テストステロン 125~250 mg、1回/2~4週、筋注
精索静脈瘤は思春期以降の男性に好発する蔓状静脈叢の怒張とうっ血であり、左右内精索静脈の解剖学的相違から左側に多いです。左腎静脈から左内精索静脈、さらに蔓状静脈叢への静脈血の逆流がおもな発生機序と考えられています。一般成人男性の8-23%に認められ、その多く(75%)は正常な造精機能を有しますが、一方で男性不妊症患者の21-39%で精索静脈瘤を認めます。造精機能障害をきたす原因については、静脈の逆流による精巣内温度の上昇などが考えられていますがいまだに不明です。手術の目的は内精索静脈を結紮遮断して逆流を消失させることであり、手術療法(精索静脈結紮術)による精液所見の改善率は60‐70%、自然妊娠率は約30%といわれています。ただし奥さんの年齢などにより時間的制約がある場合や、術後の改善がみられない場合はARTが検討されます。
4. 薬剤による造精機能障害
潰瘍性大腸炎の治療薬であるサラゾピリンは精子形成能を障害します。男性ホルモン投与はLH分泌抑制から造精機能障害を起こします。
精巣組織がある種の抗癌剤に曝露されることで、精祖細胞の分化が障害され、結果として男性不妊症に至ります9)。癌と診断され精神的に動揺している状態では、未婚男性や挙児を希望している既婚男性であっても、まず自身の生命予後に関心が集中し、精子の凍結保存まで考慮することは容易ではありません。小児の場合はなおさら、その将来の造精機能までを親や医療従事者側が考慮に入れることは困難ですが、完全寛解や治癒が期待できるようであれば、患者のQOL(quality of life)を高める上で妊孕性にも配慮した医療が求められます10)。抗癌剤のうち、リンパ腫に対するアルキル化剤のprocarbazineを含むレジメンでは不可逆的な不妊症となることがほとんどですが、一方でdoxorubicin hydrochloride、bleomycin、vinblastine, 、dacarbazine は造精機能に与える影響は有意に少なく、多くは正常レベルに回復するとされます11)。また、精巣腫瘍に対するcisplatinを中心とした化学療法では、ほとんどが一時的な無精子症に陥るものの、治療後2年で約50%、5年で80%が回復するといわれています。また、不可逆性の造精機能障害に至った症例でもMD-TESEにより精子が採取可能な場合があります。癌治療後の造精機能障害が懸念される症例では、治療前に射出精子を凍結保存しておくことにより、その精子を前述のICSIに供することで挙児が期待できます。また、男性癌患者における妊孕性温存の手段として、精子の凍結保存は唯一の確立した方法です。反面、思春期前の男子については射出精子を凍結保存することが不可能であり、小児において癌治療と並行していかに妊孕性を温存するかが今後の課題の一つと考えられます10)。Fujitaらはマウスを用いた研究にて、白血病を再発させることなく精原幹細胞の自家移植が可能であることを示しており12)、小児白血病患者における生殖細胞自家移植による妊孕性温存に道を開くものとして、この分野における今後の研究成果が期待されます。
5. ムンプス精巣炎
思春期以降のムンプスウィルス感染は14-35%で精巣炎を併発し、罹患精巣の30-50%に萎縮が起こります13)。多くは片側性ですが17-30%は両側罹患との報告もあります。片側罹患であっても対側精巣に徐々に変性性変化が生じ、高度乏精子症や無精子症になりえます。可逆性のものもあり、また不可逆性の例でもTESEにより精子を得られる可能性があります。
6. その他
停留精巣、精巣捻転症、精巣外傷、発熱、精巣への放射線照射などにより造精機能が障害されます。精上皮は放射線障害に対して非常に感受性が高いです。精巣への線量が0.2Gy未満では血清FSH(卵胞刺激ホルモン)値や精子数に対する有意な影響はありませんが、0.2-0.7Gyでは一過性の線量依存性の血清FSH値上昇や精子濃度低下をきたし、12-24か月以内に正常に復します。不可逆的な無精子症が必発な線量閾値は定まってはいませんが、1.2Gy以上では造精機能回復の可能性が低下し、回復するとしてもそれにかかる期間は線量依存性です。2Gy以上では不可逆となることが多いとされます11)。
停留精巣の約20%が触診で所在部位の明らかでない非触知精巣で、そのうち20-30%が腹腔内精巣です。停留精巣の頻度は0.8%で、停留精巣の4%が腫瘍化し、全胚細胞腫瘍の10%は停留精巣より発生します。5歳までに精巣固定術を施行すれば腫瘍発生は稀で、10歳までの固定術は腫瘍発生のリスクを大いに軽減します。一方、思春期以後の固定術はリスク軽減に全く影響せず、摘除すべきとされます。ただし、幼小児例ことに両側例では、第二次性徴への影響を考慮し安易に摘除するべきではないとされます。摘除の適応は、思春期以降で対側精巣が健常な例、高度な萎縮精巣、精巣性女性化症候群や性腺異常発生症などの性分化異常例で女児として養育することが決定している場合などに限られます。停留精巣の腫瘍発生平均年齢は40歳であり、精巣固定術施行例では長期の経過観察が必要となります。思春期を過ぎたら精巣の自己チェック、腫瘍マーカ−採取が推奨されます。精巣自己検診指導はコスト及び侵襲がなく、精巣腫瘍の早期診断に有効です。成人例では、今後の挙児希望の有無、摘除した場合、摘除せず固定した場合(固定術をすれば腫瘍化の発見容易であることなど)のメリットデメリットを説明した上で、摘除か固定かを選択していただきます。
7. 特発性造精機能障害
造精機能障害症例の多くは、明らかな原因が不明です。その精液所見に応じて非内分泌療法(血行改善剤、ビタミン剤、漢方製剤など)、内分泌療法(抗エストロゲン剤、性腺刺激ホルモン放出ホルモン; GnRH 製剤、ゴナドトロピン療法など)、ARTが順次選択されます。これら非内分泌、内分泌療法といった経験的治療には、有効性の高い、確立されたものは少ないです。他方で小数例での検討で有効であったとする報告もあり、限られた一部の症例ではその効果が期待される場合もあります。しかしその効果は依然限られたものであり、精液所見が著しく不良で自然妊娠が不可能に近いと考えられる症例ではより早期にARTに移行するべきです。
8. 精子無力症
- 抗精子抗体:男性不妊症患者の約10%で血中、精漿中、精子上に抗精子抗体が検出されます。それが受精に重要な抗原に対するものであれば受精が障害され(免疫性不妊症)、治療法として体外受精(IVF)やICSIが必要となります。精路閉塞(精管切断術後)や精巣外傷は抗精子抗体産生を誘発します。
- 膿精液症:精液に白血球が多く混じっている病態であり、原因として精路感染症や特発性のものがあります。妊孕性に影響しないことも少なくありませんが、無力精子症の原因となることがあります。慢性前立腺炎などの慢性精路感染症では抗生剤の長期投与を要することが多いです。また、精子が精細管内で精祖細胞から分化形成される過程には76日間を要するため、非特異的治療を行うにしてもその効果をみるには最低3ヶ月程度必要です。ただし、社会的、肉体的要因(特に奥さんの年齢)に留意する必要があり、効果の低い治療をいたずらに続けることなく、精液所見の改善が見られない場合には、適切なタイミングで配偶者間人工受精(AIH)を含めたARTを検討するべきです。
- immotile cilia症候群:精子は生存しているが、精子鞭毛の異常のため運動率はほぼ0%です。通常のIVFでは受精が成立せず、ICSIが必要です。
- 精子死滅症:ほとんどの精子がエオジン染色陽性で、精嚢異常拡張症などによります。精巣上体または精巣精子を用いたICSIが必要です。
9. 奇形精子症
高度の奇形率を示すものでは、ICSI以外に有効な治療法はありません。
- 精路の通過障害
精巣上体炎後(炎症消退後も精巣上体に硬結が残ることがあります)、精管、射精管閉塞に伴う二次性閉塞 (長期間の精路内圧上昇による精巣上体管の破裂、閉塞によります)、Young症候群(慢性気道疾患に両側精巣上体頭部閉塞を伴います)のほか、原因不明(原因不明の閉塞性無精子症の多くは精巣上体での閉塞です)のものもあります。
これら精巣上体の閉塞では、可能であれば自然妊娠をめざして顕微鏡下精巣上体精管吻合術が第一選択として考慮されます。精路再建が不可能な症例や奥さんの年齢、社会的状況などによっては精巣上体精子、精巣精子を用いたICSIの適応となります。
2. 精管の閉塞
避妊手術としての精管切断術後や鼠径ヘルニア術後などの精管閉塞においても、精巣側精管断端内容液中に精子を認め、尿道側精管が開通しており、精管欠損部が短ければ顕微鏡下精管精管吻合術にて自然妊娠をめざすべきです。吻合不可能な症例ではやはり精巣上体精子、精巣精子を用いたICSIを検討します。先天性精管欠損(本症の64%が嚢胞性繊維化症の責任遺伝子に変異をもつとされますが、同疾患の頻度が低い本邦では、変異の頻度は非常に低いとされています)では、精路再建は物理的に不可能であり、精巣上体精子、精巣精子を用いたICSIの適応です。
3. 射精管の閉塞
先天性(ミューラー管嚢胞、ウォルフ管形成不全)、外傷、手術や感染、炎症のほか、精嚢異常拡張症によるものがあります。これらでは内視鏡的手術(経尿道的射精管切開術)により、開通が得られる症例が存在します。しかし再狭窄も多いため、初期からARTを念頭においた治療戦略が必要です。
- 射精障害
1. 無射精
射精には陰部神経、下位胸髄から上位腰髄(Th10-L2)に存在する脊髄射精中枢、胸腰部交感神経などが関与しており、これらの機能障害が起こると無射精となります。脊髄損傷では受傷後の射精の可否は損傷レベルとその程度によります。直腸癌手術の際のリンパ節郭清や精巣腫瘍における後腹膜リンパ節郭清によっても無射精を生じえます。射精障害の原因となる交感神経損傷部位は交感神経幹、下腸間膜動脈起始部周囲とそれ以下の大動脈前面、上下腹神経叢、下腹神経であり、これらの温存術式が提唱されています。治療法は、バイブレーターによる振動刺激、電気射精法(経直腸的に精嚢、前立腺を電気刺激して射精を誘発)がありますが、これらの無効例ではART(TESE-ICSI)の適応となります。
2. 逆行性射精
正常の射精には仙髄(S2-4)を介した内尿道口の閉鎖が必要ですが、この閉鎖が障害されると精液は膀胱へ排出され、逆行性射精となります。外尿道口より射出する精液量が少ないかあるいは認められません。orgasm後の尿中に精子を認めます。原因としては、手術による神経損傷(後腹膜リンパ節郭清、直腸癌手術、腹部大動脈・腸骨動脈の手術)や糖尿病による神経障害、多発性硬化症、薬剤(α1ブロッカー)、前立腺、膀胱頚部の手術後などがあります。治療としては、神経学的病因であれば薬物療法が行われることが多いです。内尿道口の閉鎖不全を改善させる目的で交感神経α刺激薬(塩酸イミプラミン、アモキサピン)が使用されます。これらの効果がなく順行性射精が得られない場合や薬物療法の適応がない場合には、膀胱より精子を回収しAIHあるいはIVFを行います。これらでも挙児を得られないなら、最終的には精巣上体精子、精巣精子を用いたICSIの適応となります。
男性不妊症に対するARTの問題点
クラインフェルター症候群では、採取された精子の染色体核型は正常であることが多いとされ、実際ICSIでの出生例のほとんどが46,XYまたは46,XXの正常核型です。2004年のreviewでは、ICSI (精巣内および射出精子による)で49例の正常児が生まれ、2例の47XXY胎児妊娠(人工中絶)が報告されています2)。ただし、射出精子での検討ではモザイク型での性染色体異常が0.9-2.5%、純系では2.5%-21.6%であり14)、ARTにより47,XXYや47,XXXの児が生まれるリスクがより高いことを念頭に置くべきです。常染色体異常症例では、各々の不均衡核型精子の出現頻度、およびそれによる再発性流産、不均衡核型奇形児出生のリスクを十分説明した上で、羊水、絨毛による胎児染色体検査も検討するべきです。ICSIを行うことで、従来は次世代を残すことが不可能であった患者が挙児を得、その場合これらの遺伝形質が次世代に引き継がれることになりえます。Y染色体微小欠失症例では患者さんに最新の情報を公開し、前述のリスクを十分に説明した上でARTを検討する必要があります15)。着床前診断はデュシェンヌ型筋ジストロフィーを回避する目的で認められたのみで、日本では厳しく制限されていましたが、今後検討が必要な問題です。無精子症患者に対する遺伝カウンセリングについては受精卵診断など倫理的な問題を多く含んでおり、また男性不妊症における遺伝カウンセリング自体がいまだ十分に機能しているとはいえませんが、今後徐々に確立していく必要があると考えます。
文献
- Imamoto T, et al. Reprod Med Biol. 2003; 2: 31-5.
- Lanfranco F, et al. Lancet 2004; 364: 273-83.
- Vernaeve V, et al. Hum Reprod. 2004; 19: 1135-9.
- Kamischke A, et al. J Androl. 2004; 25: 586-92.
- Kühnert B, et al. Hum Reprod. 2004; 19: 886-8.
- Vijesh VV, et al. Genet Test Mol Biomarkers. 2015; 19: 150-5.
- Miyagawa Y, et al. J Urol. 2005; 173: 2072-5.
- Fahmy I, et al. Hum Reprod. 2004; 19: 1558-61.
- Shetty G, Meistrich ML. J Natl Cancer Monogr Inst. 2005; 34: 36-9.
- The Ethics Committee of the American Society for Reproductive Medicine. Fertil Steril. 2005; 83: 1622-8.
- Howell SJ, Shalet SM. J Natl Cancer Monogr Inst. 2005; 34:12-7.
- Fujita K, et al. J Clin Invest. 2005; 115: 1855-62.
- 今本 敬,ほか.日不妊会誌 2002; 47: 13-7.
- Guttenbach M, et al. Biol Reprod. 2000; 63: 1727-9.
- Mau Kai C, et al. Hum Reprod. 2008; 23: 1669–78.